ⓔコラム7-4-1 非結核性抗酸菌 (non–tuberculous mycobacteria: NTM) 症のホスト側からみた病態
臨床的特徴
NTM症は多様な臨床像を示し,臨床像ごとに病態生理が異なると考えられる.特に全身播種型は,小児におけるmendelian susceptibility to mycobacterial disease (MSMD,メンデル遺伝型マイコバクテリア易感染症),また,成人においてはヒト免疫不全ウイルス (human immunodeficiency virus: HIV)/後天性免疫不全症候群 (エイズ) (acquired immunodeficiency syndrome: AIDS) 患者や抗IFN–γ中和自己抗体陽性の患者に認める病態である.これらホストの細胞性免疫に明らかな異常を有する病態のほかに,環境に常在する元来弱毒菌であるNTMが基本的にはヒトからヒトに感染することなく,ヒトに感染症を起こすことから感染しやすい菌側の要因が考えられる一方で,ホスト側にもNTMが感染しやすい要因があることが示唆される (図1).ここではそれらホスト側からの問題について述べる.
非結核性抗酸菌の性状
抗酸菌は菌体の乾燥重量の40%以上は,炭素鎖長が60~90個の長鎖分岐脂肪酸であるミコール酸を中心とする抗酸菌に特徴的な脂質成分である1).
このミコール酸は自然界にはほとんど存在せず,ほかの病原微生物には認めない.これらの脂質成分は抗酸菌の最外層に存在しているため,菌と宿主との接点になる重要な分子である.その他にもマイコバクテリウム・アビウムコンプレックス (Mycobacterium avium complex: MAC) の糖脂質分子としてホスファチジルイノシトールマンノシド (phosphatidylinositol monnosides: PIM),リポアラビノマンナン (Lipoarabinomannan: LAM),リポマンナン (Lipomannan: LM) などが知られており2),これらはいずれもマクロファージや樹状細胞のパターン認識受容体 (pattern–recognition receptor: PRR) のなかでもトール様受容体 (toll–like receptor2: TLR2) により認識される3).またMACなどの複数のNTMは結核菌には存在しないGPLを細胞壁に発現している.この糖鎖構造の相違からMACは数十の血清型に分類され4),血清型により病原性・感染性が異なることが報告されている5,6).また抗酸菌は固形培地の上でコロニーを形成するがその形状,性状は肉眼的にsmoot型とrough型に大別され,細胞壁にGPLが存在するとS型を,GPLが欠落するとR型を呈する.S型からR型へ変化するとスライディング能やバイオフィルム形成能などの抗酸菌の病原因子が消失することが報告されており,コロニー形状と病原性との関連性が注目されている6,7).NTMにはこのようなほかの細菌には認められない特徴的な構造,成分を有しており,これらの刺激により惹起される生体反応が特徴的な病理組織像をつくると考えられる.この生体反応の起こり方に個体差があり,それが疾患感受性につながると考えられる.
MSMDの責任遺伝子
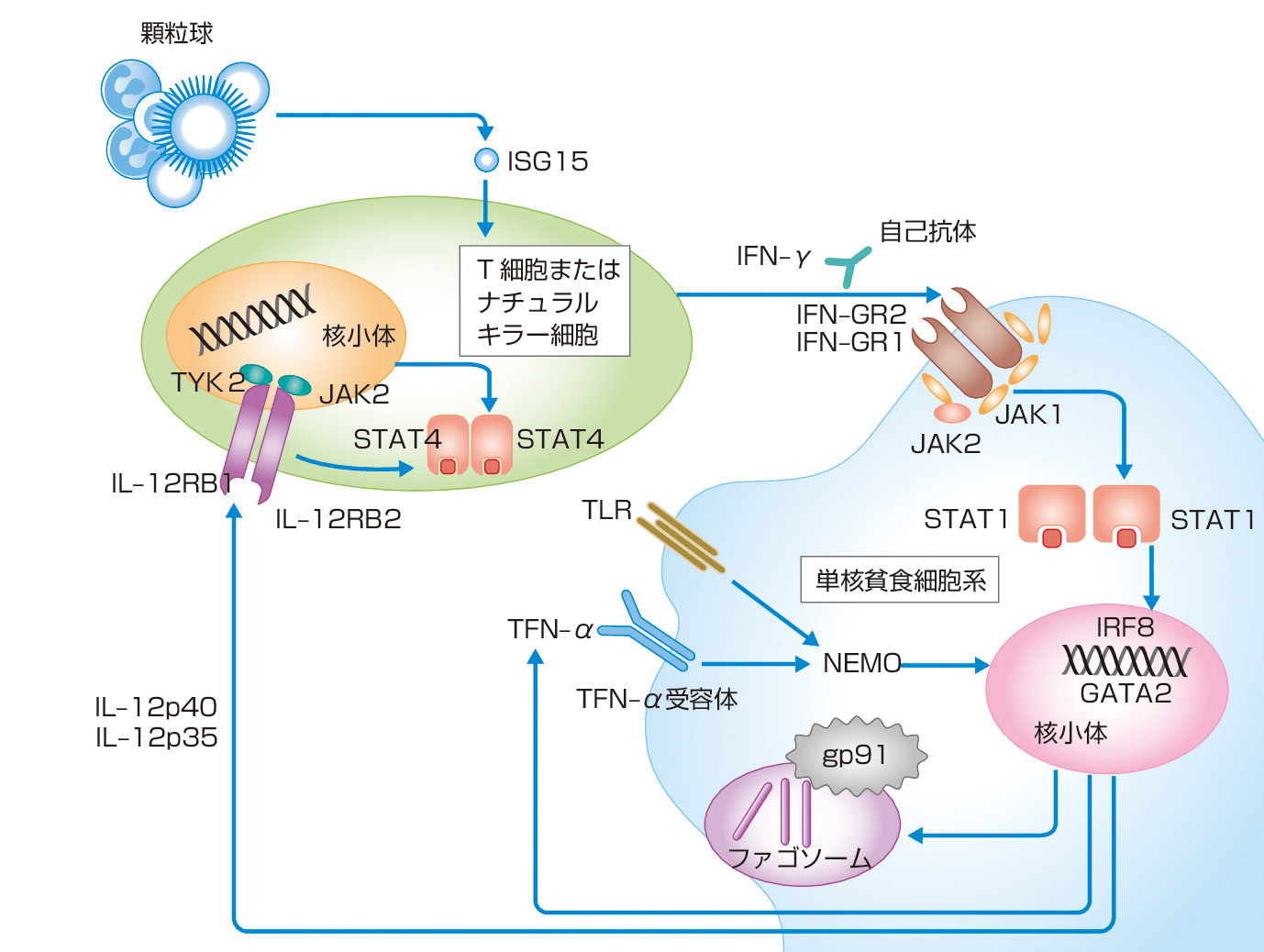
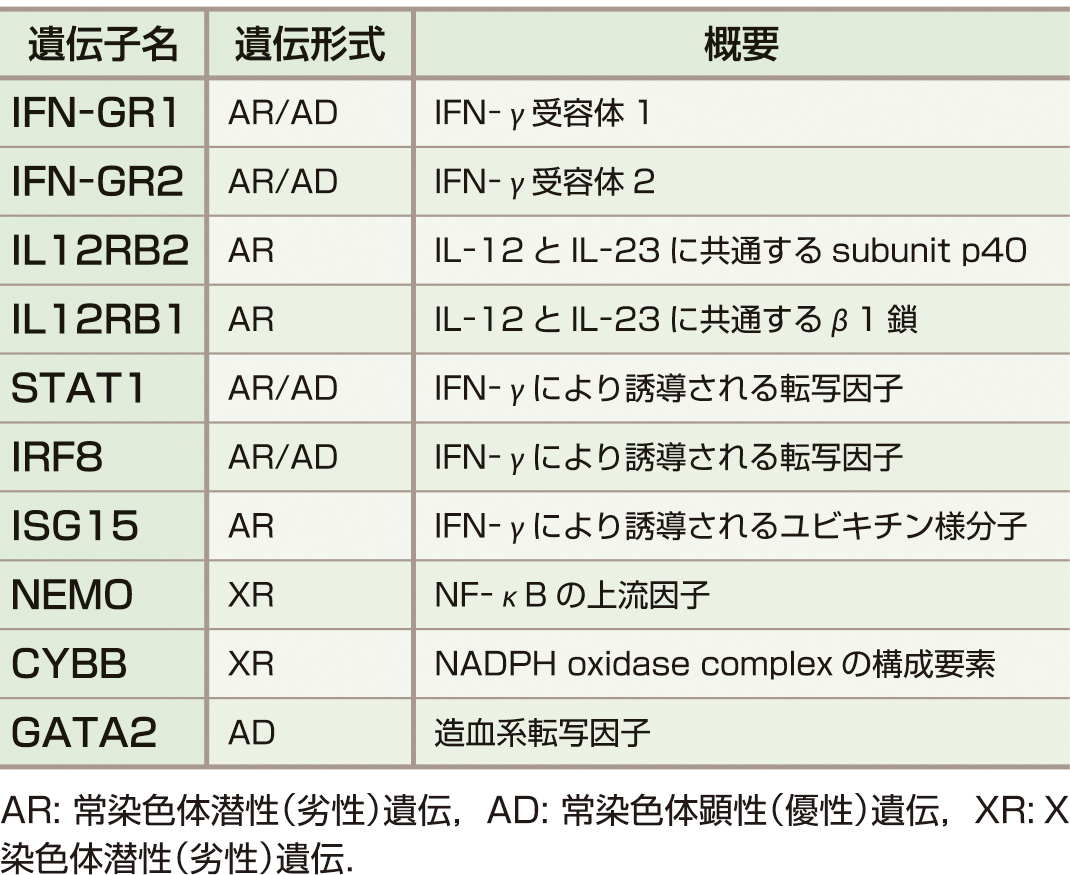
MSMDは抗酸菌に対するホストの中心的な免疫能を担うTh1を中心とする細胞性免疫反応の,Mendel遺伝様式に従って遺伝する先天的異常により惹起される疾患群である.現在までにMSMDを起こすことが報告されている遺伝子を示す (表1).IFN–γとIL–12が関与する分子から構成されている8,9).
IFN–γ関連では,IFN–γ receptor (R) 1,IFN–γR2をそれぞれコードするIFNGR1,IFNGR2,そして,シグナル伝達/転写活性化因子 (signal transducers and activation of transcription: STAT) 1,interferon regulatory factor8 (IRF8),interferon stimulated gene (ISG) をそれぞれコードするSTAT1,IRF8,ISG15の変異が,IL–12に関しては,IL–12のサブユニットp40をコードするIL12B,IL–12receptorβ1鎖をコードするIL12R B1の変異が播種型NTM症と関連することが報告されている.また,NF–κB essential modulator (NEMO) をコードするNEMOやNADPH oxidase complexを構成するgp91phoxをコードするcytochrome b (558) subunit beta (CYBB ) の変異によってもMSMDを生じる.
単球減少 (monocytopenia) と抗酸菌などの細胞内寄生菌に易感染性を示す原発性免疫不全症として2010年にmonoMAC症候群が報告されたが,後にエクソーム解析により造血系転写因子であるGATA2が原因遺伝子であることが判明した10).また,Th17細胞のマスター転写因子であるRORC遺伝子の先天的欠損により,カンジダと抗酸菌に易感染性を示す原発性免疫不全症を発症する病態が報告されている11).
抗IFN–γ中和自己抗体を介する播種型NTM症
従来,成人で発症する播種型NTM症は高度に細胞性免疫の低下したHIV感染者に発症する病態と考えられてきたが,近年,明らかな免疫不全のない成人に播種型NTM症を発症した患者から抗IFN–γ中和自己抗体が検出される例が報告されている12).後天的にサイトカインに対する自己抗体を産生する病態として注目され,肺以外にも,骨病変やリンパ節病変などを伴うことが特徴的である.抗IFN–γ中和自己抗体の報告例はアジア人が多く,わが国でも症例が集積されている.本症ではQFT検査において,全血に陽性コントロールとしてマイトジェンを作用させるとリンパ球からIFN–γが産生されるが,血中に抗IFN–γ自己抗体が存在すると産生されたIFN–γが自己抗体と結合するため,酵素結合免疫吸着測定法 (enzyme–linked immunosorbent assay: ELISA) でIFN–γが測定されず,判定不能となる13,14).これをきっかけにして本疾患が発見されることがある.しかし一般的にこの病態の認知度は低く,不明熱,粟粒 (ぞくりゅう) 結核,悪性リンパ腫,Castleman病,悪性腫瘍などと誤認されることが多い.また抗酸菌検査が検出され播種型NTM症と判明した場合でも自己抗体の存在までは調べられないこともある.一般的に治療への反応性は良好で全身に多発する病変も改善,消失する場合も多い15).しかし自己抗体が消失するわけではないので,治療を中断すると再燃する.自己抗体の産生が病態の本質であり,抗体産生を担うB細胞を標的とする抗CD20に対するモノクローナル抗体であるリツキシマブが奏効したとの報告はある16).
近年,抗IFN–γ中和自己抗体が結合するIFN–γの主要エピトープが同定されたが,このエピトープのアミノ酸配列は,アスペルギルスのNoc2蛋白質の一部分と相同性が高く,この蛋白質は患者由来の自己抗体と交差反応性があった17).しかし抗IFN–γ中和自己抗体産生の誘引はいまだ不明である.
〔長谷川直樹〕
■文献
Faria S, Jose I, et al: General overview on nontuberculous mycobacteria. Bofilm and human infection. J Pathog, 2015; 80914.
Tran T, Bonham AJ, et al: A paucity of knowledge regarding nontuberculous mycobacterial lipids compared to the tubercule bacillus.Tuberculosis (Edinb), 2019; 115: 96–107.
Killick KE, Ni Cheallaigh C, et al: Receptor–mediated recognitions of mycobacterial pathogens. Cell Microbiol, 2013; 15: 1484–1495.
Krzywinska E, Krzywinski J, et al: Phylogeny of Mycobacterium avium strains inferred from glycopeptidlipis biosynthesis pathway genes. Microbiol, 2004; 150: 1699–1706.
Fujiwara N, Ohara N, et al: Glycopeptidolipid of Mycobacterium smegmatis J15cs affects morphology and survival in host cells. PLoS One, 2015; 10: e0126813.
Gutiérrez AV, Viljoen A, et al: Glycopeptidlipids, a double–edged sword of the Mycobacterium abscessus compelx. Front Microbiol, 2018; 9: 1145.
García–Coca M, Aguilera–Correa J–J, et al: Non–pigmented rapidly growing mycobacteria smooth and rough colony phenotypes pathogenicity evaluated using in vitro and experimental models. Pathog Dis, 2019; 77: pil:ftz051.
Wu UI, Holland SM: Host susceptibility to non–tuberculpus mycobacterial infections. Lancet Infect Dis, 2015; 15: 968–980.
Elisa López–Varela, Alberto L García–Basteiro, et al: Non–tuberculous mycobacteria in children: muddying the waters of tuberculosis diagnosis. Lancet Respir Med, 2015; 3: 244–256.
Hsu AF, Smapaio EP, et al: Mutation in GATA2 are associated with the autosonmal domiat and sporadic moncytopenia and mycobacterial infection (MonoMAC) syndrome. Blood, 2011; 118: 2653–2655.
Adjemian J, Olivier KN, et al: Prevalence of nontuberculous mycobacterial lung disease in U.S. medicare beneficiaies. Am J Respir Crt Care Med, 2012; 185: 881–886.
Browne SK, Burbelo PD, et al: Adult–onset immunodeficiency in Thailand and Taiwan. N Engl J Med, 2012; 367: 725–734.
Shima K, Sakagami T, et al: Novel assay to detect increased level of neutralizing anti–interferon gamma autoantibodies in non-tuberculous mycobacterial patients. J Infect Chemother, 2014; 20: 52–56.
Suárez I, Lehmann C, et al: Repurposing QuantiFERON for detection of neutralizing interferon–γ autoantibodies in patients with nontuberculous mycobacterial infections. Clin Infect Dis, 2017; 65: 518–521.
Aoki A, Sakagami T, et al: Clinical significance of interferon–γ neutralizing autoantibodies against disseminated nontuberculous mycobacterial disease. Clin Infect Dis, 2018; 66: 1239–1245.
Browne SK, Zaman R, et al: Anti–CD20 (rituximab) therapy for anti–IFN–γ autoantibody–associated nontuberculous mycobacterial infection. Blood, 2012; 119: 3933–3939.
Lin CH, Chi CY, et al: Identification of a major epitope by anti–interferon-gamma autoantibodies in patients with mycobacterial disease. Nat Med, 2016; 22: 994–1001.